产品货号:
ALH430
中文名称:
DNA转染试剂
英文名称:
GeneFect transfection reagent
产品规格:
250T|500T
发货周期:
1~3天
产品价格:
询价
GeneFect转染试剂采用独特配方的阳离子聚合物为主要成分,可以与DNA形成稳定的复合物,保护DNA免受核酸酶的降解,在增加核酸稳定性的同时,提高转染试剂/DNA复合体穿越细胞膜的效率,这种独特设计,显著提高了基因转染效率。此类试剂是目前非病毒介导方法中效率最高的转染试剂(不同种类细胞的转染效率可有明显差异)。此外GeneFect不被血清清除,血清和抗生素不影响其转染效果,转染试剂/DNA复合物可以直接加入完全细胞培养基中。GeneFect的细胞毒性很小,在适宜的条件下,根据推荐用量使用GeneFect进行转染实验,细胞存活率高于90%.每一批产品出厂前都要对其转染效率和毒性经过严格质控。

基因转染需要一定的转染试剂将带有目的基因的载体运送到细胞内。目前,最常用的转染试剂是阳离子脂质体和阳离子聚合物,它们的特点和病毒类似,容易透过细胞膜。其中,阳离子脂质体在体外基因转染中有很高的效率,然而在体内,它迅速被血清清除,在肺组织内累积,诱发强烈的抗炎反应,这将导致高水平的毒性,因此,在很大程度上限制了其应用。由于阳离子脂质体的局限性,阳离子聚合物转染试剂日益受到重视。

- 适应于众多原代培养细胞和转化细胞株的基因转染。
- 适用于瞬时转染和稳定转染。
- 适应于贴壁细胞和悬浮细胞转染。

- 转染效率高且稳定,在有无血清存在的细胞培养基中均能获得高效率转染。
- 细胞毒性低。
- 转染程序简单,转染实验可以在半小时内完成。

| 组分 | 250T | 500T |
| GeneFect转染试剂 | 0.5mL | 1mL |
| 说明书 | 1份 | 1份 |
保存:2~8℃,有效期1年。

两种规格的GeneFect转染试剂分别可进行250次、500次转染(6孔板或35mm平皿)。

需准备150mM NaCl (超纯水配制,高压或过滤灭菌)或注射用生理盐水作为GeneFect及DNA的稀释液,和要转染的DNA溶液(高纯度,浓度0.1~2μg/μl)。

- GeneFect使用前请涡旋振荡混匀。
- 少量使用GeneFect时,可取精确量的GeneFect用无菌超纯水稀释一定倍数,以便精确取样量。该稀释液可在4℃保存1月左右。
- 细胞的生长状态是转染效率的一个主要决定因素。在实验条件许可的情况下,使用高质量的培养液、优质血清等,可能会明显提高转染效率。
- GeneFect在转染中不受血清影响,所以GeneFect/DNA复合物能直接加到含血清的培养基中,但稀释GeneFect和DNA的缓冲液不能混有血清,因为GeneFect在制备GeneFect/DNA复合物之前可能会与血清中的蛋白质反应,影响转染效率。
- 如果细胞株很敏感,孵育2~4小时后除去转染复合物并加入含血清的新鲜培养基。

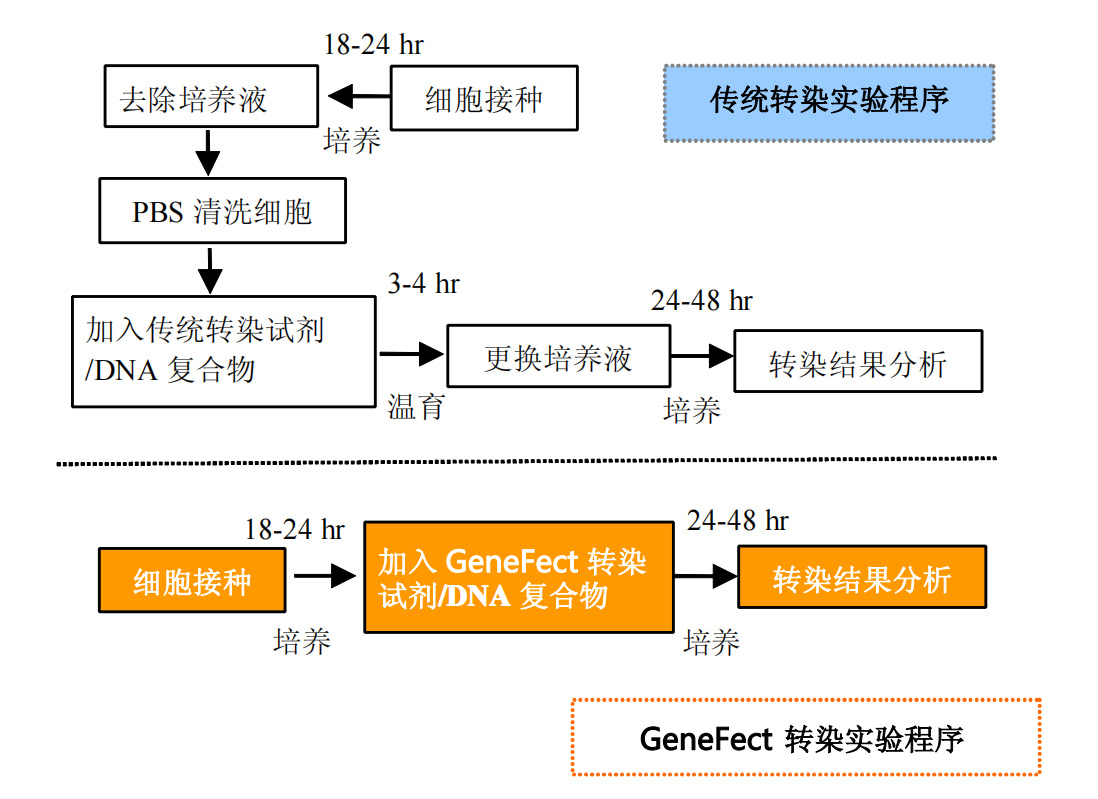
图1.GeneFect转染与传统转染实验程序比较。

- 细胞接种:
- 为了获得最好的转染效率,细胞密度应该40~80%,这因细胞株的不同而变化,对最常用的细胞株建议细胞密度50~60%。最理想条件是在转染前18~24小时,接种适量细胞置37℃,5% CO2培养。(推荐接种细胞数量见附表)
- 转染前一个小时可以考虑更换一次新鲜的培养液,体积可参考附表。
然而,对细胞毒性不敏感的细胞株可在细胞贴壁后(接种几小时后)即进行转染或者在细胞接种后立即进行转染也可以得到相近的结果。
- 为了获得最好的转染效率,细胞密度应该40~80%,这因细胞株的不同而变化,对最常用的细胞株建议细胞密度50~60%。最理想条件是在转染前18~24小时,接种适量细胞置37℃,5% CO2培养。(推荐接种细胞数量见附表)
- 配制转染工作液:
6孔板或35mm平皿,2mL培养液- 取5~8μg DNA(起始用量5μg),加入稀释液中至总体积为100μL,轻轻混匀,室温放置。
- 先将GeneFect涡旋振荡混匀。取GeneFect 1~4μL(起始用量2μL),加入稀释液中至总体积为100μL,轻轻混匀,室温放置5分钟。
- 将稀释的GeneFect逐滴加入稀释的DNA溶液中,轻轻混匀,所得的转染工作液在室温放置15分钟。
- 将转染工作液轻轻混匀,逐滴加入2mL培养液中,轻轻混匀培养液,置37℃,5%CO2培养。
- 取5~8μg DNA(起始用量5μg),加入稀释液中至总体积为100μL,轻轻混匀,室温放置。
- 细胞后续处理:
- 24~48小时后,观察或收取细胞。
- 稳定转染时,于转染后24~48小时消化细胞分至3~5个培养皿中,加适当浓度的相应抗生素(如G418)筛选。
- 24~48小时后,观察或收取细胞。

建议的起始转染条件:
| 培养容器 | 转染前一天 接种细胞数 | 转染时 培养液体积 | DNA用量 与稀释后体积 | GeneFect量 与稀释后体积 |
| 96孔板 | 1~1.5×104个 | 0.1mL | 0.25μg 5μL | 0.1μL 5μL |
| 24孔板 | 0.5~1×105个 | 0.5mL | 1.25μg 25μL | 0.5μL 25μL |
| 6孔板 | 2~4×105个 | 2mL | 5μg 100μL | 2μL 100μL |
| 35mm培养皿 | 2~4×105个 | 2mL | 5μg 100μL | 2μL 100μL |
| 60mm培养皿 | 4~6×105个 | 4mL | 10μg 200μL | 4μL 200μL |
转染过程的优化:
影响转染效率的因素有很多,细胞本身的特性和状态、转染试剂的用量、转染的DNA用量、转染试剂/DNA复合物比例、形成的复合物的形态大小、细胞数/细胞密度、细胞和转染复合物接触孵育的时间等等都可能影响转染效果,应该在具体实践中优化来确定最佳转染条件。优化后,对于同一细胞株,以后按照同样条件进行。

- 转染效率低
- 质粒浓度太低-建议:使用最适宜的质粒数量。
- 质粒纯度太低-建议:使用高质量的质粒(OD260/280>1.8)。
- 细胞生长状态欠佳-建议:保证细胞密度和形态是最佳的。
- 进一步减少转染时培养液体积(转染后6~16小时再补加足量培养液)。
- 从起始用量开始,调整配制转染液中DNA和GeneFect的用量(保持转染工作液总体积不变),以确定不同细胞的最佳转染条件。一般固定DNA用量(5μg),与系列含量的GeneFect混合,选取GeneFect的最佳用量;也可固定GeneFect用量(2μL),与系列含量的DNA混合,选取DNA的最佳用量;还可以固定GeneFect/DNA比率增加或,者减少质粒的用量。
- 设立阳性对照,例如GFP Gene和luciferase Gene-建议:以便检查转结果。
- 质粒浓度太低-建议:使用最适宜的质粒数量。
- 细胞毒性太大
- 接种前,细胞的健康状况直接影响细胞毒性。
- 转染时细胞密度不能过低。
- 增加转染时培养液体积,或保持GeneFect/DNA比率的同时减少质粒的用量。
- 对某些敏感的细胞株,转染后3~4小时去除含转染复合物的培养液,更换为新鲜的完全培养液。
- 确定基因产物是否有毒性。
- 确认质粒没有内毒素。
- 接种前,细胞的健康状况直接影响细胞毒性。
相关搜索:DNA转染试剂,基因转染,DNA转染,转染试剂,GeneFect transfection reagent



